O ataque
químico ocorreu no sábado, dia 8 de abril, e atingiu a cidade de Duma, em Guta
Oriental, na Síria. De acordo com a OMS, pelo menos 500 pessoas foram afetadas
e dezenas morreram, 49 mortos cita um comunicado conjunto divulgado pela
Sociedade Médica Sírio-Americana (SAMS, na sigla em inglês) e a Defesa Civil
síria (ONG, mais conhecida como Capacetes Brancos).
A ação foi
atribuída pelo grupo rebelde sírio Jaish al-Islam ao regime de Bashar Al-Assad.
Também os EUA, a França e o Reino Unido acusam o governo sírio de ser o
responsável pelo ataque, o que Assad e a aliada Rússia negam.
 Segundo a
BBC, o ataque ocorreu por meio de uma suposta bomba-barril disparada por um
helicóptero e contendo gás Sarín, um agente tóxico que afeta o sistema
nervoso. Esta afirmação é corroborada por uma porta-voz da Union of Medical
Relief Organizations, ONG americana que atua em hospitais sírios, que afirmou
que há relatos de pessoas com convulsões e boca espumando, sintomas
consistentes com a exposição a gás nervoso.
Segundo a
BBC, o ataque ocorreu por meio de uma suposta bomba-barril disparada por um
helicóptero e contendo gás Sarín, um agente tóxico que afeta o sistema
nervoso. Esta afirmação é corroborada por uma porta-voz da Union of Medical
Relief Organizations, ONG americana que atua em hospitais sírios, que afirmou
que há relatos de pessoas com convulsões e boca espumando, sintomas
consistentes com a exposição a gás nervoso.
Já não é a primeira vez que este
gás é usado na Síria, há um ano, em 2017, também foi utilizado num ataque
químico na província de Idlib e em 2013 em Ghouta, que deixou entre 350 e 1.500
mortos, denunciaram organismos internacionais.
Gás Sarin
· O que é?
 O gás Sarín
é um gás altamente tóxico, pertencente ao grupo dos organofosforados, cuja
fórmula molecular é C4H10PFO2. Esse gás é
encontrado na forma líquida, como um líquido claro, incolor e insípido, ou em vapor,
que possui um odor adocicado. O seu ponto de fusão é de -57°C, o ponto de ebulição
de 147°C e a densidade 1,089 g/mL. A sua ação depende do pH do meio onde ele se
encontra, ou seja, em pH ácido, entre 2 e 8 esse gás é altamente potente. Assim,
pode-se neutralizar os seus efeitos utilizando soluções alcalinas de carbonato de
sódio (Na2CO3), de hidróxido de sódio (NaOH) ou de hidróxido de
potássio (KOH).
O gás Sarín
é um gás altamente tóxico, pertencente ao grupo dos organofosforados, cuja
fórmula molecular é C4H10PFO2. Esse gás é
encontrado na forma líquida, como um líquido claro, incolor e insípido, ou em vapor,
que possui um odor adocicado. O seu ponto de fusão é de -57°C, o ponto de ebulição
de 147°C e a densidade 1,089 g/mL. A sua ação depende do pH do meio onde ele se
encontra, ou seja, em pH ácido, entre 2 e 8 esse gás é altamente potente. Assim,
pode-se neutralizar os seus efeitos utilizando soluções alcalinas de carbonato de
sódio (Na2CO3), de hidróxido de sódio (NaOH) ou de hidróxido de
potássio (KOH).
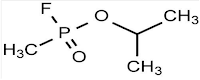 |
| Estrutura química do gás Sarín |
Foi descoberto acidentalmente em 1936 por Gerhard Scharader, químico
alemão, durante uma síntese de defensivos agrícolas. O gás Sarín fez parte de uma classe de armas
químicas desenvolvidas durante a Segunda Guerra Mundial.
Por ser um gás perigoso não há divulgação de sua síntese, pois, se isso
acontecer poderá ser fabricado e utilizado de forma inadequada.
· Como atua?
Quando entra no organismo, através dos olhos, da pele, e também pela
ingestão ou inalação, este atua no sistema nervoso central impedindo o
funcionamento da enzima acetilcolinesterase, enzima responsável por evitar a acumulação de acetilcolina, um neurotransmissor que transmite impulsos nervosos ao
organismo (ação essencial na comunicação entre neurónios).
Assim, o gás Sarín ao inibir a ação da enzima acetilcolinesterase, vai
provocar a acumulação da acetilcolina no organismo, que em excesso faz com que
os neurónios morram em poucos segundos após a exposição, um processo que
normalmente demora vários anos. Em concentrações de 200 mg de sarín/m³, age
muito rápido no organismo causando a morte em poucos minutos. Por isso, o
tratamento com um antídoto deve ser feito o mais rápido possível, para diminuir
o risco de morte.
· Quais os seus sintomas?
− Coriza (inflamação das fossas nasais, que é
caracterizada por um corrimento nasal) e olhos aguados;
−
Pupilas pequenas e contraídas;
−
Dor nos olhos e visão turva;
−
Excesso de transpiração;
−
Sensação de aperto no peito e tosse;
−
Náuseas, vómitos e diarreia;
−
Dor de cabeça, tonturas ou confusão;
−
Fraqueza em todo o corpo;
−
Alteração do batimento cardíaco.
Estes sintomas podem surgir em poucos segundos após respirar o gás Sarin
ou em alguns minutos ou horas, se o contato acontecer pela pele ou pela ingestão
da substância na água, por exemplo.
Nos casos mais graves, em que existe um contato muito prolongado, podem
surgir efeitos mais intensos como desmaio, convulsões, paralisia ou parada
respiratória.
· O que fazer em caso de exposição?
Quando existe uma suspeita de se ter entrado em contato com o gás Sarín ou
existe risco de estar em um local afetado por um ataque com este gás, é
aconselhado sair o mais rapidamente da área e ir imediatamente para um local
com ar fresco. Se possível, deve-se preferir um local alto, pois o gás Sarín é
pesado e apresenta tendência para ficar mais perto do solo.
 Também é
recomendado retirar toda a roupa, devendo-se cortar camisetas, uma vez que
passá-las por cima da cabeça, aumenta o risco de respirar a substância. Além
disso, deve-se lavar todo o corpo com água e sabão e passar água nos olhos durante 10 a 15 minutos. Nunca fazer respiração boca a boca na vítima. Depois destes
cuidados, deve-se ir rapidamente ao hospital ou chamar ajuda médica.
Também é
recomendado retirar toda a roupa, devendo-se cortar camisetas, uma vez que
passá-las por cima da cabeça, aumenta o risco de respirar a substância. Além
disso, deve-se lavar todo o corpo com água e sabão e passar água nos olhos durante 10 a 15 minutos. Nunca fazer respiração boca a boca na vítima. Depois destes
cuidados, deve-se ir rapidamente ao hospital ou chamar ajuda médica.
· Qual é o tratamento?
O tratamento deve ser iniciado o mais rápido possível e pode ser feito
com o uso de dois remédios que são um antídoto para a substância:
- Prolidoxima: destrói a ligação do gás aos recetores
nos neurónios, terminando sua ação.
 |
| Estrutura química da prolidoxima |
- Atropina: impede que a acetilcolina em excesso se
ligue aos recetores dos neurónios, contrariando o efeito do gás.
 |
| Estrutura química da atropina |
Estes dois medicamentos podem ser dados no hospital diretamente na veia
e, por isso, é que, caso exista suspeita de exposição ao gás Sarin, é
aconselhado ir imediatamente ao hospital.
· Por que é difícil provar a utilização do seu uso?
De acordo com a especialista em biossegurança Sean Kaufman, do Centro da
Universidade de Emory, a sua capacidade de se dispersar rapidamente torna difícil
a deteção do gás. Para se obter uma boa evidência de que o gás Sarín foi
utilizado, os investigadores precisam de estar no local, colher amostras de sangue
ou de cabelo diretamente das áreas afetadas pelo agente químico.
 Infelizmente, este gás está na mão
de pessoas com más intenções, que o utilizam como arma química, acabando por
matar e prejudicar a saúde de muitas pessoas que que nem sequer estão
envolvidas na guerra. Esta é uma realidade horrível dos dias de hoje e é por
isso que estar informado sobre esta gás, já causador de tantas mortes, é tão
importante.
Infelizmente, este gás está na mão
de pessoas com más intenções, que o utilizam como arma química, acabando por
matar e prejudicar a saúde de muitas pessoas que que nem sequer estão
envolvidas na guerra. Esta é uma realidade horrível dos dias de hoje e é por
isso que estar informado sobre esta gás, já causador de tantas mortes, é tão
importante.
Cátia Costa nº 7
Melissa Almeida nº 20
Sara Silva nº 26
12º N1
Fontes:
https://www.infoescola.com/compostos-quimicos/gas-sarin/
https://g1.globo.com/mundo/noticia/ataque-quimico-na-siria-deixa-dezenas-de-mortos-dizem-ongs-governo-assad-nega-autoria.ghtml
https://www.tuasaude.com/efeitos-do-gas-sarin/
https://g1.globo.com/mundo/noticia/oms-diz-que-500-pessoas-apresentaram-sintomas-de-um-ataque-quimico-em-guta-na-siria.ghtml
https://oglobo.globo.com/mundo/ataque-quimico-na-siria-que-o-gas-sarin-21170440
http://www.intertox.com.br/arma-quimica-sarin



 Este,
em pequenas quantidades (baixa concentração), pode causar irritação nos olhos,
dor de garganta e queda de tenção. Quando a sua concentração é elevada,
bloqueia as vias respiratórias e bloqueia o sistema nervoso, devido à sua
volatilidade, impedindo o funcionamento dos pulmões, podendo assim levar à
morte por asfixia e não devido ao seu mau cheiro característico, cheirando este
a ovo podre, que, dependendo da concentração pode levar a que a vítima deixe de
sentir o seu mau cheiro, uma vez que esta anestesia o sistema olfativo.
Este,
em pequenas quantidades (baixa concentração), pode causar irritação nos olhos,
dor de garganta e queda de tenção. Quando a sua concentração é elevada,
bloqueia as vias respiratórias e bloqueia o sistema nervoso, devido à sua
volatilidade, impedindo o funcionamento dos pulmões, podendo assim levar à
morte por asfixia e não devido ao seu mau cheiro característico, cheirando este
a ovo podre, que, dependendo da concentração pode levar a que a vítima deixe de
sentir o seu mau cheiro, uma vez que esta anestesia o sistema olfativo.