Resposta à adivinha anterior: Cloreto de sódio (NaCl), mais conhecido como sal.
Já agora...
Os cristais iónicos são constituídos por iões, apresentam ligações iónicas que mantém a suas unidades estruturais coesas. No geral, os compostos iónicos são duros mas quebradiços, não são voláteis e apresentam pontos de fusão e de ebulição elevados. No estado sólido são maus condutores de calor e de eletricidade.
São exemplos de cristais iónicos o NaCl (cloreto de sódio); LiF (fluoreto de lítio), AgCl (cloreto de prata) e ZnO (óxido de zinco), entre muitos outros... Podem ser representados simbolicamente assim...
Em relação ao cloreto de sódio(NaCl)
apresenta as seguintes características/propriedades:
- ponto de fusão 801 ºC
- ponto de ebulição 1465 ºC
- energia de coesão 779 kJ/mol
- massa molar 58,442 g/mol
- densidade 2,165 g/dm3
- cor branca com o seguinte aspeto
 Retirado de:https://www.google.pt/searchq=cristais+de+cloreto+de+s%C3%B3dio&source=lnms&tbm=isch&sa=X&ved=0ahUKEwij1b_nPbXAhVDtRoKHb2kBZUQ_AUICigB&biw=1366&bih=662#imgrc=4WKmQh9aLgd3fM:
Retirado de:https://www.google.pt/searchq=cristais+de+cloreto+de+s%C3%B3dio&source=lnms&tbm=isch&sa=X&ved=0ahUKEwij1b_nPbXAhVDtRoKHb2kBZUQ_AUICigB&biw=1366&bih=662#imgrc=4WKmQh9aLgd3fM:
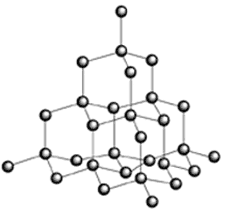
As
figuras seguintes são representações espaciais dos iões Na+ e Cl- na rede (conjunto tridimensional de pontos repetidos
regularmente) cristalina.

Passou à pouco tempo um documentário na RTP "Sal dinâmico" que apresentava uma das potencialidades da utilização dos Sal.
"O sal e a água do mar como fontes de energia no futuro
Poderemos satisfazer todas as nossas necessidades energéticas a partir da água do mar e do sal que ela contém? Será possível utilizar o sal como fonte energia em motores, fábricas e iluminação de cidades? Poderá ser esta a solução para deixarmos de usar combustíveis fósseis? Este documentário explora as últimas pesquisas sobre a água do mar e a forma como cientistas de todo o mundo estão a trabalhar na "Energia Azul". Esta é a pesquisa que pode trazer grandes mudanças ao nosso futuro."
Fonte: https://www.rtp.pt/programa/tv/p34391
Em breve apresentaremos um resumo...
Catarina Guerreiro
Iúri Silva
Raquel Reis
12ºN1